Esta seção de Healing Earth ajuda você a começar a responder ao seguinte conjunto de perguntas que foram colocadas ao final do estudo de caso:
Análise Detalhada
O USGS Water Science School é um site interativo sobre água e um bom recurso para investigar com mais profundidade os tópicos apresentados nesta seção.
- Que propriedades da água a tornam essencial para a vida na Terra?
- Qual a condição atual dos recursos hídricos do planeta?
- Quais são os principais impactos humanos na qualidade e quantidade de água no mundo atualmente?
A água é tão comum em nosso planeta que suas extraordinárias propriedades são frequentemente negligenciadas. É dela que se compõe quase 70% da massa do corpo humano e até 95% da massa corporal das plantas. A água ajuda a tornar a Terra habitável para organismos e tem um papel essencial nos processos fisiológicos. Todas essas características incríveis da água começam com a molécula.
A Estrutura da Água
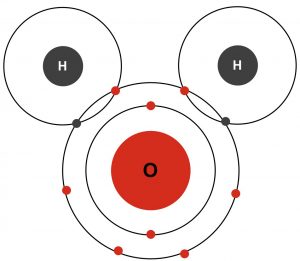
A água é uma molécula (H2O) que contém dois átomos de hidrogênio, cada um compartilhando um par de elétrons com um átomo de oxigênio (veja a Figura 1). Quando os átomos compartilham os elétrons dessa maneira, uma ligação covalente é criada. Essas ligações são essenciais para os organismos vivos.
Nas moléculas de água, os átomos de oxigênio e hidrogênio compartilham os elétrons de forma desigual. Os elétrons, que sempre carregam uma carga negativa, são atraídos mais fortemente pelos átomos de oxigênio. Como os elétrons compartilhados passam mais tempo circundando o núcleo de oxigênio e menos tempo circundando os núcleos dos átomos de hidrogênio, a molécula de água se torna polarizada com extremidades negativas (oxigênio) e positivas (hidrogênio) distintas. Esta propriedade é denominada polaridade molecular.
Uma vez que as cargas positivas e negativas se atraem mutuamente, as moléculas polares de água se alinham quando se aproximam uma da outra – a extremidade positiva de hidrogênio de uma molécula é atraída para a extremidade negativa de oxigênio de uma segunda molécula. Essa atração é chamada de ligação de hidrogênio (veja a Figura 2). Moléculas de água são levemente conectadas por ligações fracas de hidrogênio, o que dá à água sua propriedade líquida. Se as ligações de hidrogênio fossem mais fortes, a água seria uma substância rígida, em vez de fluida.
Análise Detalhada
Esta publicação da E. R. Johnson Research Foundation, Universidade da Pensilvânia, apresenta uma descrição mais detalhada da estrutura e propriedades da água.
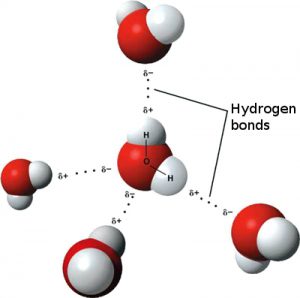
Uma gota de água contém trilhões de moléculas de água unidas por ligações fracas de hidrogênio. A tendência das moléculas de água de se ligarem é chamada de coesão. O fato de as moléculas de água serem coesas usando ligações fracas de hidrogênio é o que dá à água sua consistência fluida.
A polaridade da água também a torna adesiva, o que significa que ela será atraída por outros tipos de moléculas com cargas positivas e negativas. Pense em como as árvores transportam a água do solo até seus ramos mais altos sem qualquer tipo de bomba. Moléculas de água entram na raiz e aderem às moléculas que compõem as paredes dos tecidos condutores da planta, chamadas de células do xilema, que têm a forma de pequenos canudos. A água evapora no ar na extremidade oposta do xilema – a folha – causando um impulso para cima em toda a coluna de água e substituindo a água que foi vaporizada.
Olhando adiante

Mais adiante neste capítulo você aprenderá que a bela e vivificante fluidez da água cria o que muitas religiões do mundo veem como a importância espiritual da água.
Coesão e adesão são algumas das qualidades mais notáveis da água. Elas são fortes o suficiente para trabalhar contra a força da gravidade, permitindo que a água se mova para o topo de uma árvore de centenas de metros de altura. Esse movimento é chamado de ação capilar e é um meio fundamental de transporte de fluidos através das estruturas das plantas.
Solvência da Água
Um solvente é uma substância capaz de dissolver outras substâncias. A água é um solvente universal devido à sua capacidade de dissolver a maioria das outras substâncias polares. Você já adicionou sal de mesa à água antes de cozinhar macarrão ou arroz? Nesse caso, você provavelmente notou que o sal eventualmente pareceu “sumir”.
Olhando adiante

Na seção Água e Espiritualidade adiante você aprenderá que a solvência da água torna possível o que muitas religiões do mundo veem como a importância espiritual da água em sua qualidade de purificação e cura.
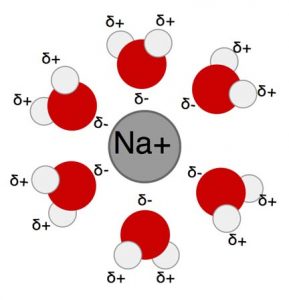
Sal de mesa (NaCl) é feito de íons que, por causa de suas cargas, se separam e se dissolvem facilmente em água. O sal se dissolve na água porque as moléculas de água formam uma atração mais favorável aos íons de sal do que a atração dos íons de sal um pelo outro (veja a Figura 3). Moléculas ou partes de moléculas que são atraídas por moléculas de água são chamadas de hidrofílicas (ou seja, “amantes da água”).
Muitos nutrientes que sustentam a vida são hidrofílicos. Sendo um solvente universal, a água é um meio essencial para o transporte de nutrientes vitais. A água também pode transportar muitas substâncias nocivas à vida, como pesticidas. A solvência da água a torna um agente de limpeza útil, mas também torna possível a contaminação do nosso suprimento de água essencial.
Os Três Estados Físicos da Água
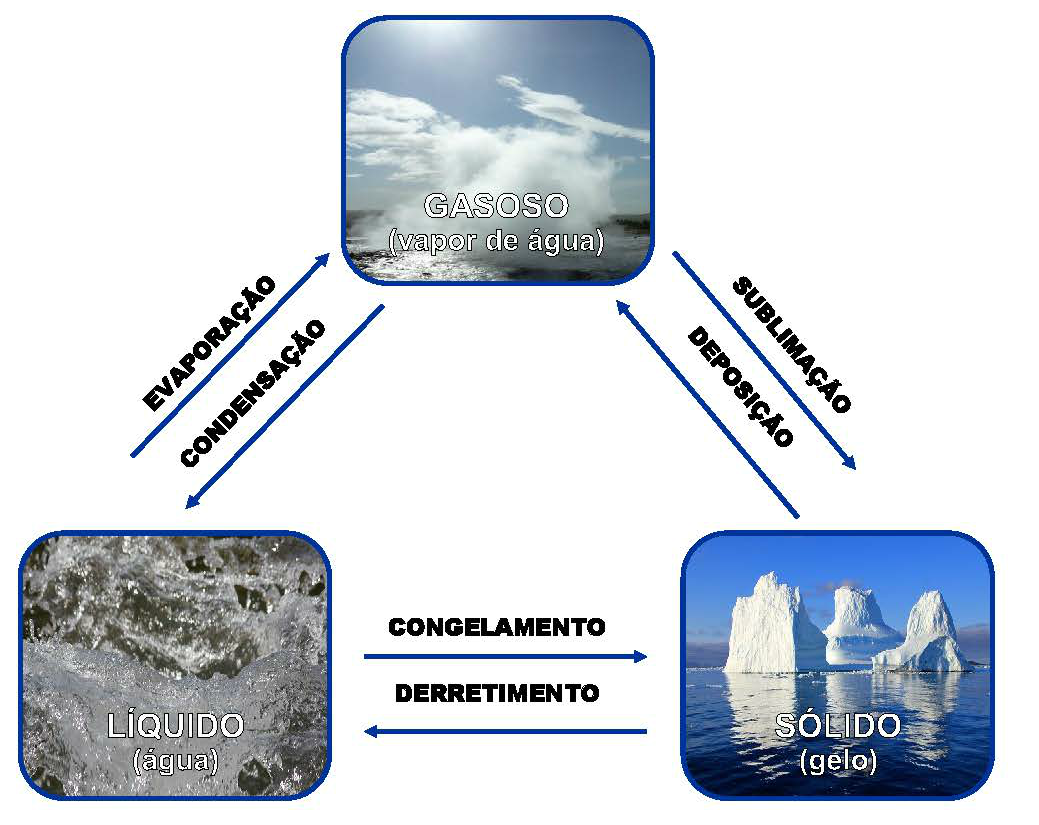
A água é a única substância na Terra que ocorre naturalmente em três estados físicos: sólido, líquido e gasoso (ver Figura 4). Dependendo da temperatura e pressão atmosférica, a água pode mudar de um estado para outro, um processo chamado mudança de fase física. Por causa disso, algumas regiões geográficas do mundo experimentam umidade, chuva, neve ou até mesmo uma combinação dos três.
Análise Detalhada

Moléculas de água do vapor de água têm poucas ligações de hidrogênio e mais espaço entre elas, tornando o vapor leve e menos denso que a água ou o gelo. Embora as moléculas de H₂O ficam mais próximas na água líquida do que no gelo sólido, há menos ligações de hidrogênio na água líquida do que na estrutura rígida do gelo. Portanto, a água é fluida enquanto o gelo é sólido. Este video demonstra os três estados das moléculas de água.
As ligações de hidrogênio são novamente a chave. O número de ligações entre as moléculas determina se a água será sólida, líquida ou gasosa. No estado sólido, as moléculas de água têm o número máximo de ligações de hidrogênio (4 por molécula), dando à água a característica rígida do gelo. Em seu estado líquido, a água tem menos ligações de hidrogênio, o que explica seu caráter fluido e menos estruturado.
À medida que a água muda de sólido para líquido e então para gasoso, as ligações de hidrogênio são quebradas, dando às moléculas de água mais liberdade de movimento. Esta ciclagem de água através de seus estados é a base para o ciclo hidrológico que é essencial para a vida na terra, purificando a água e distribuindo-a através das massas de terras. Este importante ciclo é discutido na seção sobre ciclo hidrológico adiante.
Densidade da Água
A água é uma das poucas substâncias na Terra que é menos densa como um sólido do que como um líquido. Como gelo, as moléculas de água formam quatro ligações de hidrogênio que as prendem em uma estrutura cristalina rígida. Nesse estado, as moléculas de água estão mais afastadas do que quando estão em estado líquido. É por isso que a água se expande à medida que congela e é menos densa do que a água líquida circundante. Como a água sólida é menos densa, o gelo flutua na superfície de um lago no inverno e isola a água abaixo contra o congelamento, proporcionando um benefício vital aos organismos aquáticos. Se a água em sua forma sólida fosse mais densa que a água em sua forma líquida, os lagos e lagoas congelariam completamente durante o inverno, e não mais forneceriam habitats viáveis.
Do mesmo modo, peixes e outras espécies em regiões polares e temperadas evoluíram para viver em lagos quando as temperaturas externas caem abaixo do ponto de congelamento da água (32ºF, 0ºC). Esses organismos aquáticos possuem uma faixa de tolerância relativamente ampla para mudanças de temperatura ao longo do ano. No entanto, a faixa de tolerância a que as espécies se adaptaram está a ser ameaçada por mudanças de temperatura induzidas pela mudança climática global. Novas informações são dadas abaixo e no Capítulo 6 sobre os efeitos das mudanças climáticas globais sobre a água.
