L’eau: Eau et science
Cette section de Pour guérir la Terre vous aide à commencer à répondre à l’ensemble des questions suivantes qui ont été posées à la fin de l’étude de cas :
- Quelles sont les propriétés de l’eau qui la rendent essentielle à la vie sur Terre ?
- Quelle est la condition actuelle des ressources en eau de la planète ?
- Quels sont les principaux impacts humains sur la qualité et la quantité de l’eau dans le monde aujourd’hui ?
L’eau est si commune sur notre planète que ses propriétés extraordinaires sont souvent négligées. Il représente près de 70% de la masse du corps humain et jusqu’à 95% de la masse corporelle végétale. L’eau contribue à rendre la Terre habitable pour les organismes et joue un rôle essentiel dans les processus physiologiques. Ces caractéristiques incroyables de l’eau commencent toutes par la molécule.
L’ USGS Water Science School est un site Web interactif sur l’eau et une bonne ressource pour approfondir les sujets présentés dans cette section.
La structure de l’eau
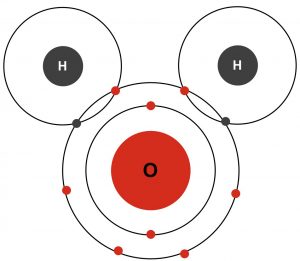
L’eau est une molécule (H2O) qui contient deux atomes d’hydrogène partageant chacun une paire d’électrons avec un atome d’oxygène (voir figure 1). Lorsque les atomes partagent les électrons de cette manière, une liaison covalente est créée. Ces liaisons sont essentielles aux organismes vivants.
Dans les molécules d’eau, les atomes d’oxygène et d’hydrogène partagent inégalement les électrons. Les électrons, qui portent toujours une charge négative, sont attirés plus fortement vers les atomes d’oxygène. Parce que les électrons partagés passent plus de temps à faire le tour du noyau d’oxygène et moins de temps à faire le tour des noyaux des atomes d’hydrogène, la molécule d’eau se polarise avec des extrémités distinctes négatives (oxygène) et positives (hydrogène). Cette propriété est désignée comme étant la polarité moléculaire.
Étant donné que les charges positives et négatives s’attirent, les molécules d’eau polaires s’alignent lorsqu’elles se rapprochent – l’extrémité positive d’hydrogène d’une molécule est attirée par l’extrémité négative d’oxygène d’une seconde molécule. Cette attraction s’appelle une liaison hydrogène (voir figure 2). Les molécules d’eau sont reliées entre elles par de faibles liaisons hydrogène, ce qui confère à l’eau sa propriété liquide. Si les liaisons hydrogène étaient plus fortes, l’eau serait une substance rigide plutôt que fluide.
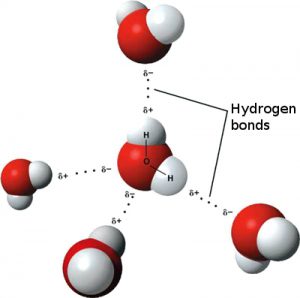
Une goutte d’eau contient des billions de molécules d’eau maintenues ensemble par de faibles liaisons hydrogène. La tendance des molécules d’eau à se lier est appelée cohésion. Le fait que les molécules d’eau se lient en utilisant de faibles liaisons hydrogène est ce qui donne à l’eau sa consistance fluide.
La polarité de l’eau la rend également adhésive, ce qui signifie qu’elle sera attirée par d’autres types de molécules avec des charges positives et négatives. Pensez à la façon dont les arbres transportent l’eau du sol vers leurs hautes branches sans aucune sorte de pompe. Les molécules d’eau pénètrent dans la racine et adhèrent aux molécules qui composent les parois des tissus conducteurs de la plante, appelées cellules du xylème, qui ont la forme de minuscules pailles. L’eau s’évapore dans l’air à l’extrémité opposée du xylème – la feuille – provoquant une traction cohérente vers le haut sur toute la colonne d’eau et remplaçant l’eau vaporisée.
Cet article publié à la ER Johnson Research Foundation, Université de Pennsylvanie présente une description plus approfondie de la structure et des propriétés de l’eau.
La cohésion et l’adhésion sont quelques-unes des qualités les plus remarquables de l’eau. Ils sont assez solides pour lutter contre la force de gravité, permettant à l’eau de se déplacer vers le haut d’un arbre de plusieurs centaines de pieds de haut. Ce mouvement est appelé action capillaire et est un moyen clé pour les plantes de transporter des fluides à travers leur corps.
Solvabilité dans l’eau
Un solvant est une substance capable de dissoudre d’autres substances. L’eau est un solvant universel en raison de sa capacité à dissoudre la plupart des autres substances polaires. Avez-vous déjà ajouté du sel de table à de l’eau avant de faire bouillir des pâtes ou du riz ? Si c’est le cas, vous avez probablement remarqué que le sel semblait finalement «disparaître».
Plus loin dans ce chapitre, vous apprendrez que la fluidité de l’eau qui coule à merveille rend possible ce que de nombreuses religions du monde considèrent comme la signification spirituelle de l’eau.
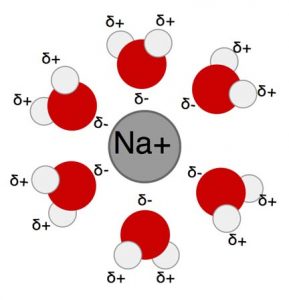
Le sel de table (NaCl) est composé d’ions qui, en raison de leurs charges, se séparent et se dissolvent facilement dans l’eau. Le sel se dissout dans l’eau parce que les molécules d’eau forment une attraction plus favorable aux ions sel que l’attraction des ions sel les uns aux autres (voir la figure 3). Les molécules ou parties de molécules qui sont attirées par les molécules d’eau sont appelées hydrophiles (c.-à-d. « Aimant l’eau »).
De nombreux nutriments qui soutiennent la vie sont hydrophiles. Parce que l’eau est un solvant universel, c’est un milieu essentiel pour le transport des nutriments vitaux. L’eau peut également transporter de nombreuses substances nocives pour la vie, comme les pesticides. La solvabilité de l’eau en fait un nettoyant utile, mais elle rend également possible la contamination de notre approvisionnement en eau essentiel.
Les trois états physiques de l’eau
L’eau est la seule substance sur Terre qui se produit naturellement dans trois états physiques : solide, liquide et gazeux (voir figure 4). Selon la température et la pression atmosphérique, l’eau peut passer d’un état à un autre, un processus appelé changement de phase physique. Pour cette raison, certaines régions géographiques du monde connaissent l’humidité, la pluie, la neige ou même une combinaison des trois.
Dans la section Eau et spiritualité ci-dessous, vous apprendrez que la solvabilité de l’eau rend possible ce que de nombreuses religions du monde considèrent comme la signification spirituelle de l’eau dans sa qualité purificatrice et curative
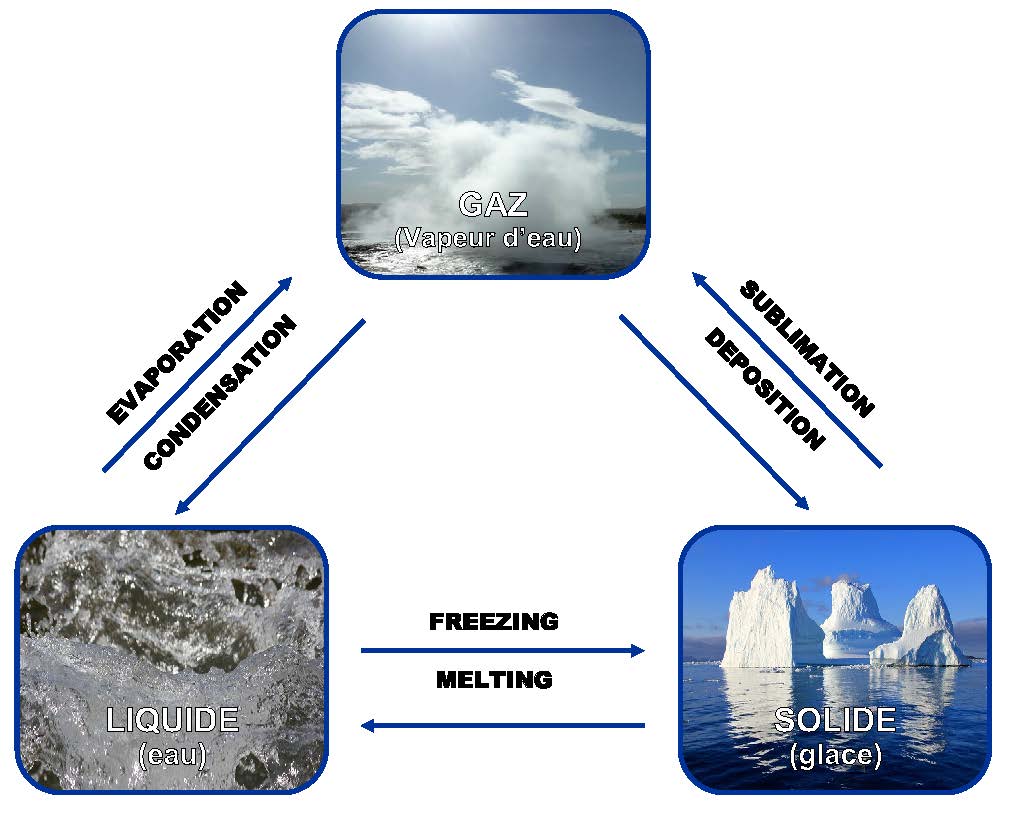
Les liaisons hydrogène sont à nouveau la clé. Le nombre de liaisons entre les molécules détermine si l’eau sera solide, liquide ou gazeuse. À l’état solide, les molécules d’eau ont le nombre maximum de liaisons hydrogène (4 par molécule), donnant à l’eau la caractéristique rigide de la glace. À l’état liquide, l’eau a moins de liaisons hydrogène, ce qui explique son caractère fluide moins structuré.
Au fur et à mesure que l’eau passe du solide au liquide en gaz, les liaisons hydrogène sont rompues, ce qui donne aux molécules d’eau plus de liberté de mouvement. Ce cycle de l’eau à travers ses états est la base du cycle hydrologique essentiel à la vie sur terre, purifiant l’eau et la répartissant sur les masses terrestres. Cet important cycle est discuté dans la section cycle hydrologique ci-dessous.
Densité de l’eau
L’eau est l’une des rares substances sur Terre qui est moins dense sous forme solide que liquide. Sous forme de glace, les molécules d’eau forment quatre liaisons hydrogène qui les enferment dans une structure cristalline rigide. Dans cet état, les molécules d’eau sont en fait plus éloignées que lorsqu’elles sont à l’état liquide. C’est pourquoi l’eau se dilate lorsqu’elle gèle et est moins dense que l’eau liquide environnante. Parce que l’eau solide est moins dense, la glace flotte à la surface d’un lac en hiver et isole l’eau en dessous du gel, procurant un avantage vital aux organismes aquatiques. Si l’eau sous sa forme solide était plus dense que l’eau sous sa forme liquide, les lacs et les étangs gèleraient au fond pendant l’hiver et ne fourniraient plus d’habitats viables.
En l’état, les poissons et autres espèces des régions polaires et tempérées ont évolué pour vivre dans les lacs lorsque les températures extérieures tombent en dessous du point de congélation de l’eau (32 °F, 0 °C). Ces organismes aquatiques possèdent une gamme relativement large de tolérance aux changements de température tout au long de l’année. Cependant, la plage de tolérance à laquelle les espèces se sont adaptées est menacée par les changements de température induits par le changement climatique mondial. Nous en dirons plus ci-dessous et au chapitre 6 sur les effets du changement climatique mondial sur l’eau.
Les molécules d’eau dans la vapeur d’eau ont peu de liaisons hydrogène et plus d’espace entre elles, rendant la vapeur légère et moins dense que l’eau ou la glace. Alors que les molécules H2O sont plus rapprochées dans l’eau liquide que dans la glace solide, il y a moins de liaisons hydrogène dans l’eau liquide que dans le réseau rigide de glace. Par conséquent, l’eau est fluide tandis que la glace est solide. Cette vidéo montre les trois états des molécules d’eau.