Esta sección de Sanando la Tierra te ayuda a responder el siguiente conjunto de preguntas que se plantearon al final del estudio de caso:
Mirar en detalle
La ciencia del agua para escuelas de la USGS es un sitio web interactivo sobre el agua y un buen recurso para investigar más a fondo los temas presentados en esta sección.
- ¿Cuáles son las propiedades del agua que la hacen esencial para la vida en la Tierra?
- ¿Cuál es la condición actual de los recursos hídricos del planeta?
- ¿Cuáles son los principales impactos humanos en la calidad del agua y la cantidad en el mundo actual?
El agua es tan común en nuestro planeta que sus extraordinarias propiedades a menudo son pasadas por alto. Comprende casi 70% de la masa del cuerpo humano y hasta 95% de la masa corporal de una planta. El agua ayuda a que la Tierra sea habitable para los organismos y tiene un papel esencial en los procesos fisiológicos. Estas increíbles características del agua comienzan con la molécula.
La estructura del agua
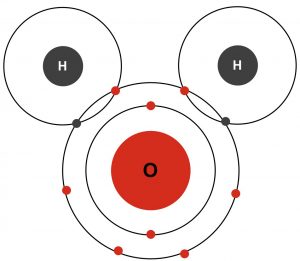
El agua es una molécula (H2O) que contiene dos átomos de hidrógeno cada uno compartiendo un par de electrones con un átomo de oxígeno (ver la Figura 1). Cuando los átomos comparten electrones de este modo, se crea un enlace covalente. Estos enlaces son esenciales para los organismos vivos.
En las moléculas del agua, el oxígeno y los átomos de hidrógeno comparten electrones en distintas proporciones. Los electrones, que siempre llevan una carga negativa, son atraídos con mayor fuerza a los átomos de oxígeno. Debido a que los electrones compartidos pasan más tiempo rodeando el núcleo del oxígeno y menos tiempo circulando el núcleo de los átomos de hidrógeno, la molécula de agua se polariza con los extremos negativos (oxígeno) y positivos (hidrógeno). Esta propiedad se conoce como polaridad molecular.
Ya que las cargas positivas y negativas se atraen, las moléculas polares de agua se alinean cuando se aproximan unas a las otras: el extremo positivo de hidrógeno de una molécula es atraído por el extremo negativo de oxígeno de una segunda molécula. Esta atracción se llama enlace de hidrógeno (ver la Figura 2). Las moléculas de agua están unidas entre sí por enlaces débiles de hidrógeno, lo que da al agua su propiedad líquida. Si los enlaces de hidrógeno fueran más fuertes, el agua sería una sustancia rígida, en lugar de fluida.
Mirar en detalle
Este documento publicado en el E.R. Johnson Research Foundation, de la Universidad de Pensilvania, presenta una descripción más detallada de la estructura y las propiedades del agua.
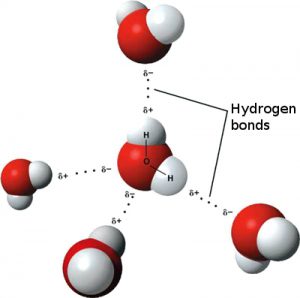
Una gota de agua contiene trillones de moléculas de agua unidas por enlaces débiles de hidrógeno. La tendencia de las moléculas de agua a unirse se llama cohesión. El hecho de que las moléculas de agua se unan utilizando enlaces débiles de hidrógeno es lo que le da al agua su consistencia fluida.
La polaridad del agua también lo hace adhesiva, lo que significa que será atraído por otros tipos de moléculas con cargas positivas y negativas. Piensa en cómo los árboles transportan el agua desde el suelo hasta sus ramas altas sin ningún tipo de bomba. Las moléculas de agua entran en la raíz y se adhieren a las moléculas que forman las paredes de los tejidos conductores de la planta, llamadas células del xilema, que tienen la forma de pequeñas pajillas para beber. El agua se evapora en el aire en el extremo opuesto del xilema –las hojas– provocando un tirón ascendente y cohesivo en toda la columna de agua y reemplazando el agua que se evaporó.
Mirando hacia el futuro

Más adelante en este capítulo, aprenderás que el agua fluye maravillosamente, y es esta fluidez vivificante del agua lo que hace posible lo que muchas religiones del mundo ven como el significado espiritual del agua.
La cohesión y la adhesión son algunas de las cualidades más notables del agua. Son lo suficientemente fuertes para trabajar contra la fuerza de la gravedad, lo que permite que el agua se mueva hacia la parte superior de un árbol a cientos de metros de altura. Este movimiento se denomina acción capilar y es una forma clave sobre como las plantas transportan líquidos a través de sus cuerpos.
Solvencia del agua
Un solvente es una sustancia capaz de disolver otras sustancias. El agua es un solvente universal debido a su capacidad para disolver la mayoría de las otras sustancias polares. ¿Alguna vez has añadido sal de mesa al agua antes de hervir pasta o arroz? Si es así, probablemente has notado que la sal al final pareciera “desaparecer”.
Mirando hacia el futuro

A continuación, en la sección Agua y Espiritualidad aprenderás que la solvencia del agua hace posible el que muchas religiones del mundo ven el significado espiritual del agua en su calidad purificadora y sanadora.
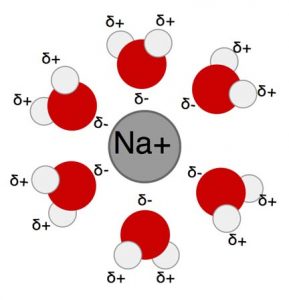
La sal de mesa (NaCl) está formada de iones que, debido a sus cargas, se separan y disuelven fácilmente en agua. La sal se disuelve en el agua, porque las moléculas de agua forman una atracción más favorable para los iones de sal que la atracción de los iones de sal entre sí (ver la Figura 3). Las moléculas o partes de las moléculas que son atraídas a las moléculas de agua se denominan hidrófilas (es decir, “amante del agua”).
Muchos nutrientes que sustentan la vida son hidrofílicos. Debido a que el agua es un solvente universal, es un medio esencial para el transporte de nutrientes vitales. El agua también puede transportar muchas sustancias nocivas para la vida, como los pesticidas. La solvencia del agua la hace un poderoso agente de limpieza, pero también hace posible la contaminación de nuestro suministro esencial de agua.
Los tres estados físicos del agua
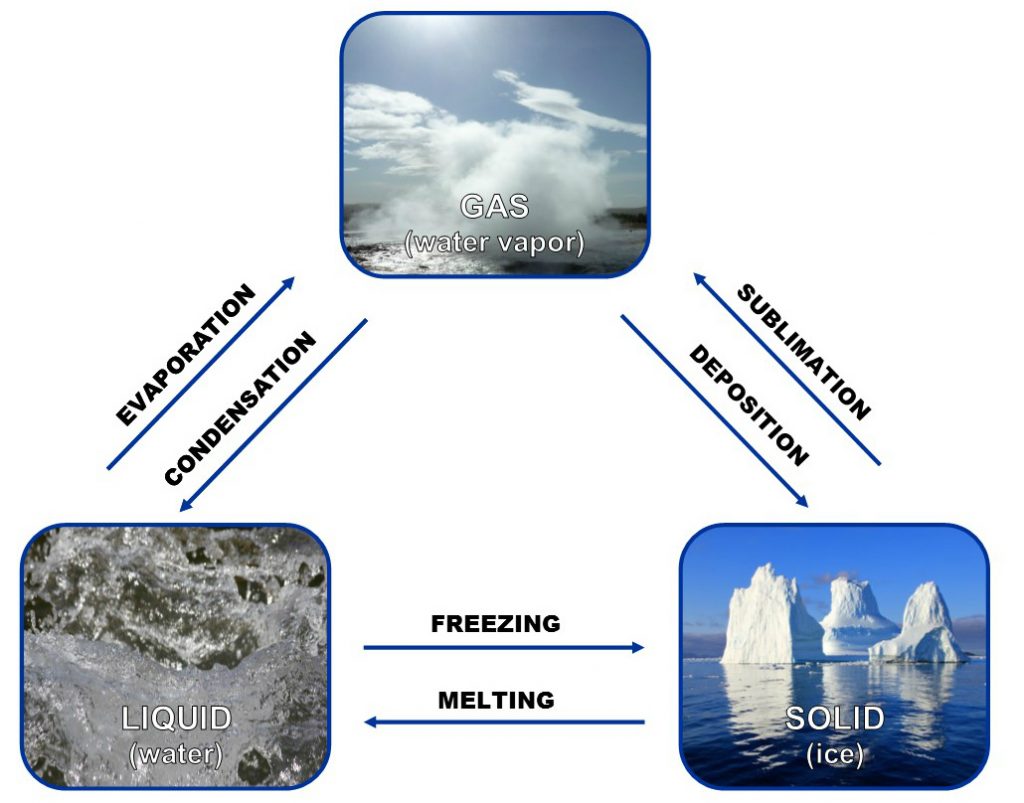
El agua es la única sustancia en la Tierra que aparece naturalmente en tres estados físicos: sólido, líquido y gaseoso (ver Figura 4). Dependiendo de la temperatura y la presión atmosférica, el agua puede cambiar de un estado a otro, un proceso que se denomina cambio de fase física. Debido a esto, algunas regiones geográficas del mundo experimentan humedad, lluvia, nieve o, incluso, una combinación de los tres.
Mirando en detalle

Las moléculas de agua en el vapor de agua tienen pocos enlaces de hidrógeno y más espacio entre ellas, haciendo que el vapor sea más ligero y menos denso que el agua o el hielo. Mientras que las moléculas del H2O están más juntas en agua líquida que en el hielo sólido, hay menos enlaces de hidrógeno en agua líquida que en el rígido entramado de hielo. Por tanto, el agua es líquido mientras que el hielo es sólido. Este video muestra los tres estados de las moléculas de agua.
Los enlaces de hidrógeno son nuevamente la clave. El número de enlaces entre moléculas determina si el agua será sólida, líquida o gas. En el estado sólido, las moléculas de agua tienen el número máximo de enlaces de hidrógeno (cuatro por molécula), lo que le da al agua la característica rígida del hielo. En su estado líquido, el agua tiene menos enlaces de hidrógeno, lo que explica su carácter menos estructurado y fluido.
Mientras el agua cambia de sólido a líquido y a gas, los enlaces de hidrógeno se rompen, dando a las moléculas del agua más libertad de movimiento. Este ciclo del agua a través de sus estados es la base del ciclo hidrológico que es esencial para la vida en la Tierra, purificando el agua y distribuyéndola a través de las masas de terrestres. Este importante ciclo se discute en la siguiente sección del ciclo hidrológico.
Densidad del agua
El agua es una de las pocas sustancias en la Tierra que es menos densa siendo sólida que líquida. Como hielo, las moléculas de agua forman cuatro enlaces de hidrógeno que las fijan dentro de una estructura cristalina rígida. En este estado, las moléculas de agua están en realidad más separadas que cuando están en estado líquido. Esta es la razón por la cual el agua se expande a medida que se congela y es menos densa que el agua líquida circundante. Debido a que el agua sólida es menos densa, el hielo flota en la superficie de un lago en el invierno y aísla el agua que está debajo de la congelación, proporcionando un beneficio vital a los organismos acuáticos. Si el agua en su forma sólida era más densa que el agua en su forma líquida, los lagos y los estanques se congelarían hasta el fondo durante el invierno y ya no proporcionarían hábitats viables.
Siendo así, los peces y otras especies en las regiones templadas y polares han evolucionado para vivir en lagos cuando las temperaturas al aire libre descienden por debajo del punto de congelación (32º F, 0ºC). Estos organismos acuáticos poseen una gama relativamente amplia de tolerancia para los cambios de temperatura durante todo el año. Sin embargo, el rango de tolerancia al que se han adaptado las especies está siendo amenazado por los cambios de temperatura inducidos por el cambio climático global. Más adelante y en el Capítulo 6 se explicarán los efectos del cambio climático global en el agua.
